Leucipo: viveu por volta de 450 a. C. (à 2.450 de anos
atrás) e dizia que a matéria podia ser dividida em partículas cada vez
menores, até chegar-se a um limite.
Democrito: discípulo de Leucipo, viveu por volta de 470 a
380 a. C. e afirmava que a matéria era descontínua, isto é, a
matéria era formada por minúsculas partículas indivisíveis, as quais foram
denominadas de átomo (que em grego significa "indivisível").
Demócrito postulou que todos os tipos de matéria era formada a partir da combinação
de átomos de 4 elementos: água, ar , terra e fogo. O modelo da matéria
descontínua foi rejeitada por um dos grandes filósofos da época, Aristóteles,
o qual afirmava que a matéria era contínua, isto é, a matéria vista
como um "todo inteiro" (contrastando com a idéia de que a
matéria era constituída por minúsculas partículas indivisíveis).
Dalton: O químico inglês John Dalton, que viveu entre 1.766 a
1.825, afirmava que o átomo era a partícula elementar, a menor partícula que
constituía a matéria. Em 1.808, Dalton apresentou seu modelo atômico: o
átomo como uma minúscula esfera maciça, indivisível, impenetrável e
indestrutível. Para ele, todos os átomos de um mesmo elemento
químico são iguais, até mesmo as suas
massas. Hoje, nota-se um equívoco pelo
fato da existência dos isótopos, os quais
são átomos de um mesmo elemento químico que possuem entre si massas diferentes
.
Seu modelo atômico também é conhecido como "modelo da
bola de bilhar".
Rutherford: As bases para o desenvolvimento da física nuclear foram lançadas por Ernest Rutherford
ao desenvolver sua teoria sobre a estrutura atômica. O cientista
estudou por três anos o comportamento dos feixes de partículas ou raios X, além da emissão de radioatividade pelo elemento Urânio. Uma das inúmeras experiências realizadas, foi a que demonstrava o espalhamento das partículas alfa. Esta foi base experimental do modelo atômico do chamado átomo nucleado
onde elétrons orbitavam em torno de um núcleo. Durante suas pesquisas
Rutherford observou que para cada 10.000 partículas alfa aceleradas
incidindo numa lâmina de ouro, apenas uma refletia ou se desviava de sua trajetória. A conclusão foi que o raio de um átomo poderia ser em torno de 10.000 vezes maior que o raio de seu núcleo. Rutherford e Frederick Soddy ainda, descobriram a existência dos raios gama e estabeleceram as leis das transições radioativas das séries do tório, do actínio e do rádio O modelo atômico de Rutherford ficou conhecido como modelo planetário, pela sua semelhança com a formação do Sistema Solar. Em 1911, Ernest Rutherford propôs o modelo de átomo com movimentos planetários. Este modelo foi estudado e aperfeiçoado por Niels Bohr, que acabou por demonstrar a natureza das partículas alfa como núcleos de hélio.
Bohr: A teoria orbital de Rutherford encontrou uma dificuldade teórica resolvida por Niels Bohr.No momento em que temos uma carga elétrica negativa composta pelos elétrons girando ao redor de um núcleo de carga positiva, este movimento gera uma perda de energia devido a emissão de radiação constante. Num dado momento, os elétrons vão se aproximar do núcleo num movimento em espiral e cair sobre si.
Em 1911, Niels Bohr publicou uma tese que demonstrava o comportamento
eletrônico dos metais. Na mesma época, foi trabalhar com Ernest
Rutherford em Manchester
, Inglaterra. Lá obteve os dados precisos do modelo atômico, que iriam lhe ajudar posteriormente.
Em 1913, observando as dificuldades do modelo de Rutherford, Bohr intensificou suas pesquisas visando uma solução teórica.
Em 1916, Niels Bohr retornou para Copenhague para atuar como professor de física. Continuando suas pesquisas sobre o modelo atômico de Rutherford.
Em 1920, nomeado diretor do Instituto de Física Teórica, Bohr acabou
desenvolvendo um modelo atômico que unificava a teoria atômica de
Rutherford e a teoria da mecânica quântica de Max Planck
.
Sua teoria consistia que ao girar em torno de um núcleo central, os
elétrons deveriam girar em órbitas específicas com níveis energizados.
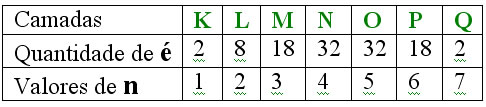
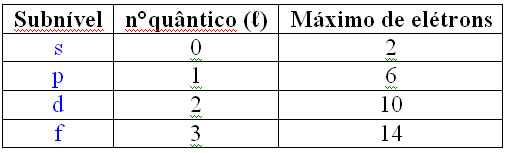
Realizando estudos nos elementos químicos com mais de dois elétrons,
concluiu que se tratava de uma organização bem definida em orbitais.
Descobriu ainda que as propriedades químicas dos elementos eram
determinadas pelo orbital mais externo. Louis Victor Pierre Raymondi, sétimo duque de Broglie) onde todo corpúsculo atômico pode comportar-se de duas formas, como onda e como partícula.
COMPONENTES: Adriele Caldas , Juliana Gonçalves , Alex Souza , Bianca Fernandes , Tauana Araujo , Tailane Ferreira. 1° 17.